28-03-2025 Publicatiedatum
31-08-2025 Enkele tekstuele aanpassingen
Inhoudsopgave
H1 Advies Gezondheidsraad bescherming tegen RSV
H2 Het criterium “Ernst en omvang van de ziektelast m.b.t. RSV”
H3 Het criterium “Effectiviteit en veiligheid van de immunisatie met nirsevimab”
H3.1 Het herziene beoordelingskader
H3.2 Bewering 1: Geen verschil ernstige bijwerkingen tussen nirsevimabgroep en placebogroep.
(Kanttekening: Onderbouwing ontbreekt)
H3.3 Bewering 2: Geen van de ernstige symptomen hield verband met nirsevimab.
(Kanttekening: Staat niet in de bronverwijzing)
H3.4 Bewering 3: In een Spaanse immuniteitscampagne zijn geen ernstige bijwerkingen gerapporteerd.
(Kanttekening: Resultaat in strijd met fase 3 onderzoek)
H3.5 Meldingen van (ernstige) bijwerkingen en overlijden in EudraVigilance
H4 Het criterium “Doelmatigheid van de immunisatie met nirsevimab”
H5 Samenvatting
H6 Conclusie – tot slot
Referenties
H1 Advies Gezondheidsraad bescherming tegen RSV
Op 14 februari 2024 heeft de Gezondheidsraad het advies “Immunisatie tegen RSV in het eerste levensjaar” nr 2024/03 uitgebracht. Dit noemen we hierna “Advies RSV Immunisatie”
…”De commissie adviseert om alle kinderen op korte termijn passieve immunisatie met antistoffen aan te bieden ter bescherming tegen RSV tijdens hun eerste RSV-seizoen. Kinderen die vlak voor of tijdens het RSV-seizoen worden geboren zouden nirsevimab zo kort mogelijk (binnen uiterlijk 2 weken) na de geboorte aangeboden moeten krijgen. Voor kinderen die na het RSV-seizoen worden geboren adviseert de commissie om voor de start van hun eerste RSV-seizoen nirsevimab aan te bieden.”…
[1] Advies RSV Immunisatie (p.35/51)
Passieve versus actieve immunisatie
Nirsevimab is de werkzame stof in het vaccin van AstraZenaca met de naam Beyfortus. Hiermee worden de kinderen passief geïmmuniseerd. De antistoffen die worden ingespoten zorgen voor een tijdelijke bescherming. Bij vaccinatie (actieve immunisatie) wordt een stof gebruikt die het immuunsysteem aanzet om antistoffen aan te maken en dit ook in het geheugen van het immuunsysteem opslaat, waardoor ook antistoffen kunnen worden aangemaakt bij een latere herinfectie.
Beoordelingskader
Voor dit advies heeft de Gezondheidsraad gebruik gemaakt van het herziene beoordelingskader dat in december 2023 is gepubliceerd. Het is meer een checklist van punten die in het advies aan de orde moeten komen. Alleen bij de doelmatigheid zijn referentiewaarden voor de kosteneffectiviteit aangegeven. Door het ontbreken van kwantitatieve grenswaarden bij de overige criteria kan de Gezondheidsraad met vrijwel elke onderbouwing vaststellen dat aan die criteria is voldaan.
Bij de volgende onderdelen in het advies van de Gezondheidsraad worden kanttekeningen geplaatst:
- ernst en omvang van de ziektelast;
- effectiviteit en veiligheid van de vaccinatie;
- doelmatigheid van de vaccinatie.
H2 Het criterium “De infectieziekte leidt tot een aanmerkelijke ziektelast in de bevolking”
Het herziene beoordelingskader
Het onderdeel "Ernst en omvang van de ziektelast" van het herziene beoordelingskader omvat de volgende elementen:
1. De infectieziekte leidt tot een aanmerkelijke ziektelast in de bevolking:
• de infectieziekte is ernstig voor individuen, en
• de infectieziekte treft (potentieel) een omvangrijke groep
[2] Herziening beoordelingskader voor vaccinaties (p.6/19)
Problemen met ernst en omvang ondervangen
De Gezondheidsraad moet beide componenten aannemelijk maken. Voor infectieziekten bij kinderen blijkt het lastig te zijn om aan beide eisen te voldoen. In de herziening van het beoordelingskader is dat glad getrokken door de Gezondheidsraad:
…”Vooral ziektes die kinderen treffen, blijken vaak niet aan beide eisen (ernstig en omvangrijk) te voldoen. Een voorbeeld is waterpokken, dat jaarlijks veel kinderen treft, maar bij slechts een zeer beperkt deel leidt tot ziekenhuisopnames of sterfte.“…
[2] Herziening beoordelingskader voor vaccinaties (p.7/19)
…” Het criterium ziektelast wordt daarom zodanig aangepast dat vaccinatie overwogen kan worden als er sprake is van een ernstige infectieziekte en/of de ziekte een (potentieel) omvangrijke groep betreft.”…
[2] Herziening beoordelingskader voor vaccinaties (p.7/19)
Door het en/of karakter heeft de Gezondheidsraad zich een aanzienlijke speelruimte toebedeeld om infectieziekte gemakkelijk als “ernstig” te kunnen aanmerken. Zodra sprake is van ziekenhuisopnamen kan de infectieziekte als ernstig worden aangemerkt zonder dat de aantallen verder van belang zijn.
Aanzienlijke ziektelast bij 1% (maar niet bij 99%)
…”De ziektelast bij kinderen tot 1 jaar door RSV is aanzienlijk, vooral bij kinderen tot 3 maanden oud. Tussen de 1 en 2% van alle kinderen wordt in hun eerste levensjaar opgenomen in het ziekenhuis vanwege een RSV-infectie.”…
[1] Advies RSV Immunisatie (p.11/51)
Het gaat nu om 1% van de kinderen in hun 1e levensjaar. Dat 99% van de kinderen in hun 1e levensjaar niet met ziekenhuisopnamen te maken krijgen kan door herziene beoordelingskader terzijde worden geschoven.
H3 Het criterium “Effectiviteit en veiligheid van de immunisatie met nirsevimab”
H3.1 Het herziene beoordelingskader

Afbeelding 1: Herziening beoordelingskader voor vaccinaties p.6/19 [2]
In deze analyse wordt alleen ingegaan op onderdeel 3. Het gaat daarbij om het punt of de Gezondheidsraad het aannemelijk heeft gemaakt dat de bijwerkingen van de immunisatie geen belangrijke afbreuk doet aan de gezondheidswinst in de bevolking.
Drie beweringen van de Gezondheidsraad, die daarop betrekking hebben, worden nader geanalyseerd en van kanttekeningen voorzien.
H3.2 Bewering 1: Geen verschil ernstige bijwerkingen tussen nirsevimabgroep en placebogroep.
(Kanttekening: Onderbouwing ontbreekt)
De gezondheidsraad schrijft hierover in het advies:
…“Er waren geen verschillen in het aantal gemelde ernstige symptomen bij voldragen en laat premature kinderen tussen de nirsevimabgroep (6,3%, 125 op de 1998) en de placebogroep (7,4%, 74 op de 996). Geen van de ernstige symptomen hield verband met nirsevimab. [78]”.
[1] Advies RSV Immunisatie: zie H4.4 Veiligheid (P.27/58)
De gezondheidsraad verwijst met noot 78 naar het onderzoek van Muller et al. “Nirsevimab for Prevention of RSV in Term and Late Preterm Infants”. [4a] In het daarbij horende Supplementary Appendix [4b] staat additionele informatie. Het artikel is gepubliceerd op 5 april 2023 in New England Journal of Medicine (NEJM) en gaat over het fase 2b/3 onderzoek met nirsevimab van AstraZeneca.[4c] Dit onderzoek noemen hier verder "het fase 3 onderzoek".
In de appendix staat (zie afbeelding 2) dat de incidentie van de bijwerkingen in de behandelingsgroepen niet wijzen op een verschil in veiligheid. Er staat niet dat dit ook geldt voor de ernstige bijwerkingen. Maar dat beweert de Gezondheidsraad wel onder verwijzing naar deze publicatie. Waar de Gezondheidsraad dat op baseert is niet duidelijk. Dit betekent dat zij deze stelling niet kunnen onderbouwen met een verwijzing naar het fase 3 onderzoek.
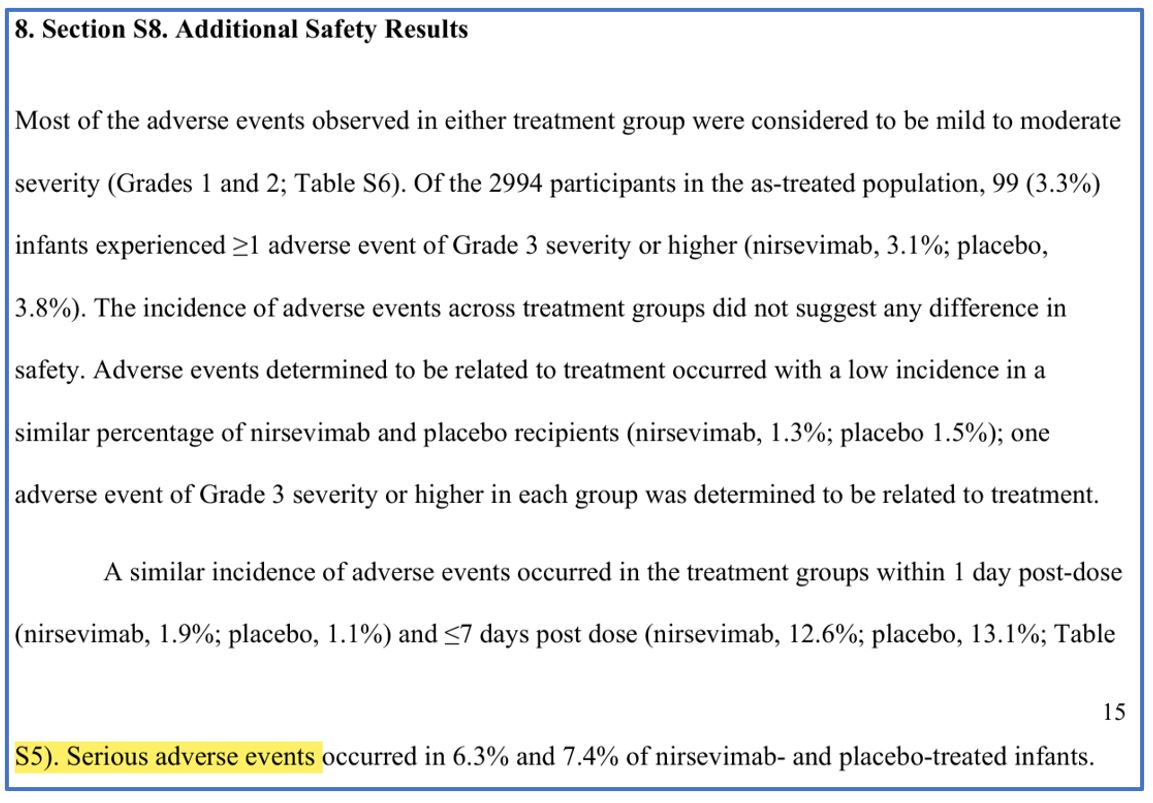 Afbeelding 2: Nirsevimab for Prevention of RSV: Supplementary Appendix p.15-16/39 [4b]
Afbeelding 2: Nirsevimab for Prevention of RSV: Supplementary Appendix p.15-16/39 [4b]
H3.3 Bewering 2: Geen van de ernstige bijwerkingen houdt verband met nirsevimab.
(Kanttekening: Staat niet in de bronverwijzing)
In de laatste zin uit het citaat van de vorige paragraaf staat:
“Geen van de ernstige symptomen hield verband met nirsevimab. [78]”
[1] Advies RSV Immunisatie: zie H4.4 Veiligheid (P.27/58)
Bewering niet terug te vinden in bronvermelding
De cijfers die worden genoemd in het advies van de Gezondheidsraad zijn terug te vinden in de appendix van het fase 3 onderzoek. In afbeelding 3 zien we boven de ernstige bijwerkingen (SAE) ook de overlijdensgevallen staan. In de voetnoot lezen we dat door de onderzoeker is vastgesteld dat de overlijdensgevallen niet gerelateerd zijn aan de immunisatie. Daar staat niet dat de gemelde ernstige bijwerkingen geen verband houden met nirsevimab. Ook nu is weer niet duidelijk waar de Gezondheidsraad zich op baseert.
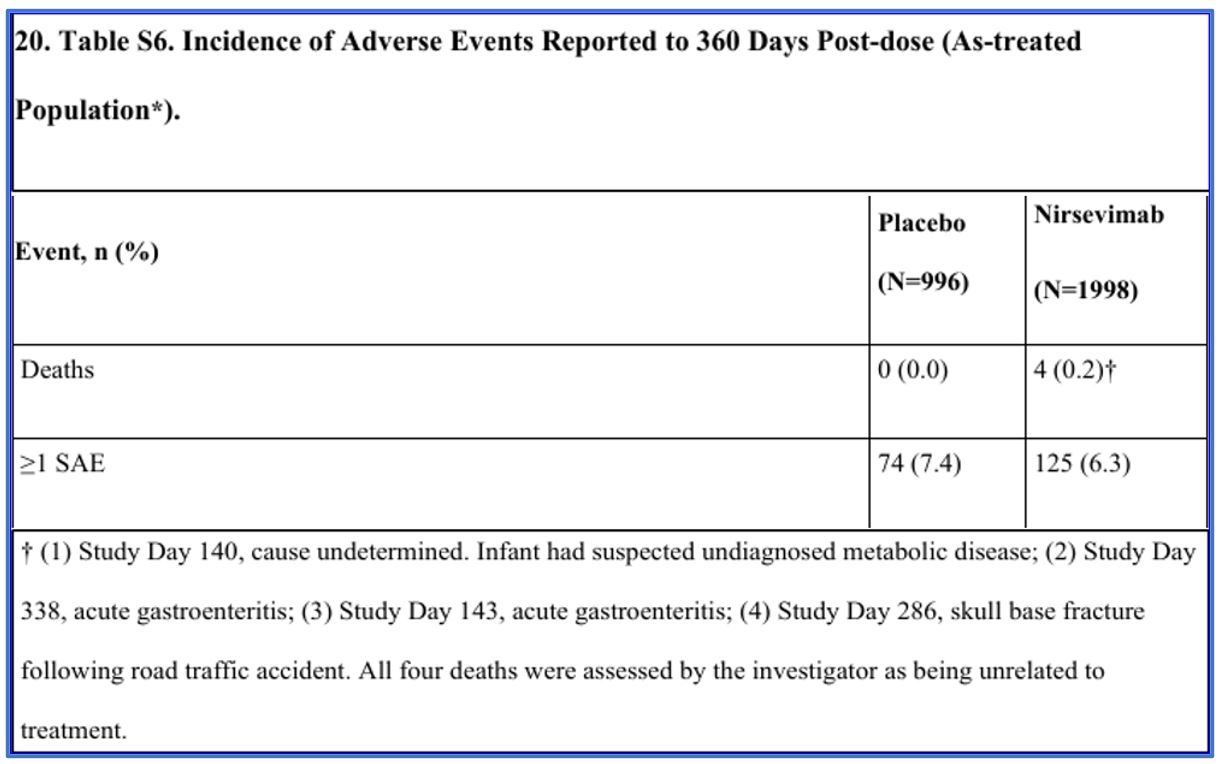 Afbeelding 3: Nirsevimab for Prevention of RSV: Supplementary Appendix p.29/39 [4b]
Afbeelding 3: Nirsevimab for Prevention of RSV: Supplementary Appendix p.29/39 [4b]
Wel overlijdensgevallen in nirsevimabgroep – geen autopsierapporten
Op bladzijde 16 van de appendix vinden we meer informatie over de oorzaak van 4 overlijdensgevallen in de nirsevimabgroep:
…”Four deaths were reported through Study Day 361 (360-days post dose) among infants in the nirsevimab group, and none in the placebo group. One 4-month-old male infant died of an unknown cause on Study Day 140; the investigator suspected undiagnosed metabolic disease. Two deaths due to acute gastroenteritis occurred: an 18-month-old female on Study Day 338 and a 7-month-old male on Study Day 143. A fourth death occurred in a 14-month-old female on Study Day 286 due to a skull fracture that occurred as the result of an automobile accident. The investigators determined that the 4 deaths were not related to treatment.”…
[4b] Nirsevimab for Prevention of RSV: Supplementary Appendix (p.16/39)
Bij het overlijden na een verkeersongeval is het duidelijk dat dit niet gerelateerd is aan nirsevimab. In de overige drie gevallen is autopsie nodig zijn om dit te kunnen bevestigen. Door het ontbreken van de autopsierapporten is nu niet onomstotelijk vast komen te staan dat deze overlijdensgevallen niet met de vaccinatie in verband gebracht kunnen worden.
Voorwaarden voor deelname en uitsluiting van deelname aan het onderzoek
In de appendix zijn 5 voorwaarden geformuleerd voor deelname aan het fase 3 onderzoek. Er zijn ook 23 voorwaarden geformuleerd voor uitsluiting van deelname daaraan.
[4b] Nirsevimab for Prevention of RSV:Supplementary Appendix (p.10/39)
De bijwerkingen, die het middel op deze kinderen heeft, blijft nu buiten beeld. Dit geldt ook voor de omvang van deze groep. De Gezondheidsraad heeft dit punt in het advies niet aan de orde gesteld.
H3.4 Bewering 3: In een Spaanse immuniteitscampagne zijn geen ernstige bijwerkingen gerapporteerd.
(Kanttekening: Resultaat in strijd met fase 3 onderzoek)
Wat betreft de veiligheid verwijst de Gezondheidsraad in hun advies ook naar het resultaat in Spanje met Nirsevimab:
…”In Spanje, waar tot nu toe 7.241 doses nirsevimab zijn toegediend, zijn geen ernstige bijwerkingen gerapporteerd.[88] “…
[1] Advies RSV Immunisatie H4.4 Veiligheid (p.27/51)
Voetnoot 88 verwijst naar de publicatie van Martinón-Torres et al. dat op 7 december 2023 is gepubliceerd in het weinig gezaghebbende Eurosurveillance waarvan het ECDC de uitgever is. Ter vergelijking: in juni 2024 had Eurosurveillance Impact Factor 9,9. Bij het New England Journal Of Medicine was dat 94,2 en bij de Lancet 98,4. [6]
Nuancerende context ontbreekt
In die publicatie komen we de volgende tekst tegen (zie afbeelding) waarbij de laatste zin zonder verdere context in het advies terecht gekomen. Daardoor draagt het nu bij aan de beeldvorming dat immunisatie met nirsevimab veilig is. Context die dit beeld zou kunnen nuanceren ontbreekt.
 Afbeelding 4: Eurosurveillance 28(49) 2300606(07/12/2023) [5]
Afbeelding 4: Eurosurveillance 28(49) 2300606(07/12/2023) [5]
Monitoring bijwerkingen immunisatiecampagne
De Spaanse publicatie heeft geen betrekking op een gerandomiseerd onderzoek met een controle groep. Het is een verslag van een 3 weken durende immunisatiecampagne. Daarin wordt aan het einde van die campagne het voorlopige resultaat gemeld. De Gezondheidsraad wijst daar in hun advies hier op.
Verder wijst de Gezondheidsraad niet op de mogelijkheid dat na 3 weken ook nog ernstige bijwerkingen gemeld kunnen worden. Kijken we naar de meldingen in EudraVigilance (stand 04-03-2025) dan blijkt dat ook 3 weken na de immunisatie met nirsevimab nog ernstige bijwerkingen zijn gemeld.
Dat geen ernstige bijwerkingen zijn gemeld tijdens de immunisatiecampagne kan te maken hebben met de wijze en duur (3 weken) van de monitoring. Zo is in het artikel sprake van een routinematige surveillance. Dat geldt niet voor de te vroeg geborenen. Zij worden nog 3 weken na de immunisatie actief worden gevolgd. Hoe groot die groep is wordt niet vermeld. We weten ook niet hoeveel kinderen uit die groep nog in de monitoringsperiode zaten aan het einde van de immunisatiecampagne.
…”Surveillance of severe adverse events following immunisation is routinely performed in all subjects through the Galician pharmacovigilance system. In addition, active surveillance of any potential adverse event or hospitalisation in the first 3 weeks since nirsevimab administration is conducted in the preterm population.”…
[5] Eurosurveillance 28(49) 2300606 (07/12/2023)
…”Er wordt routinematig toezicht gehouden op ernstige bijwerkingen na immunisatie bij alle proefpersonen via het Galicische farmacovigilantiesysteem. Daarnaast wordt er actief toezicht gehouden op mogelijke bijwerkingen of ziekenhuisopnames in de eerste 3 weken na toediening van nirsevimab bij de te vroeg geborenen ”…
Onderrapportage kenmerk passieve monitoring
We weten niet hoe de routinematige surveillance is vormgegeven. De ouders van de duizenden geïmmuniseerde kinderen zullen niet allemaal regelmatig zijn gebeld. Bij passieve monitoring komt het vaker voor dat bijwerkingen niet worden gemeld. Een fenomeen dat bekend staat als onderrapportage..
Belangenverstrengeling van de auteur
Uit de “Conclicts of interest” van Frederico Martinón-Torres bij dit onderzoek, blijkt dat we te maken met een onderzoeker, die nauw is verweven met veel farmaceuten waaronder Sanofi Pasteur. Dit bedrijf leidt de commerciële activiteiten en registreert de inkomsten rond nirsivimab. De ontwikkelings- en productieactiviteiten liggen bij AstraZeneca. [7].
 Afbeelding 5: Eurosurveillance 28(49) 2300606 (07/12/2023) [5]
Afbeelding 5: Eurosurveillance 28(49) 2300606 (07/12/2023) [5]
De context die de Gezondheidsraad weglaat
Het gaat om een publicatie uit een weinig gezaghebbende Eurosurveillance. Dat geen ernstige bijwerkingen zijn gerapporteerd heeft alleen betrekking op deze immunisatiecampagne. De resultaten zijn niet generaliseerbaar. Dat geen ernstige bijwerkingen in de 3 weken van immunisatiecampagne zijn gemeld wil niet zeggen dat die daarna niet zijn opgetreden. Kijken we naar de meldingen in EudraVigilance dan zien we dat ook 3 weken na de immunisatie met nirsevimab meldingen van ernstige bijwerkingen zijn binnengekomen. Bovendien is sprake van een belangenverstrengeling van de auteur met Sanofi die de commerciële activiteiten van Nirsevimab in handen heeft.
Voor de onderbouwing van het advies maakt het kennelijk niet uit waar of door wie iets is gepubliceerd. Ook een opmerking over de consistentie of plausibiliteit van het resultaat ontbreekt. Je zou een hogere standaard verwachten bij de Gezondheidsraad
H3.5 Meldingen van (ernstige) bijwerkingen en overlijden in EudraVigilance
In de 17 maanden tussen oktober 2023 en februari 2025 (stand 04-03-2025) zijn 664 meldingen van bijwerkingen geregistreerd in EudraVigilance. Hiervan is 68% ernstig van aard. Verder waren er 20 (3% van 664) meldingen van overlijden. Omdat 94% (425 van 452) van de ernstige bijwerkingen zijn gemeld door zorgprofessionals is het niet uit te sluiten dat de immunisatie daarbij een rol speelt.
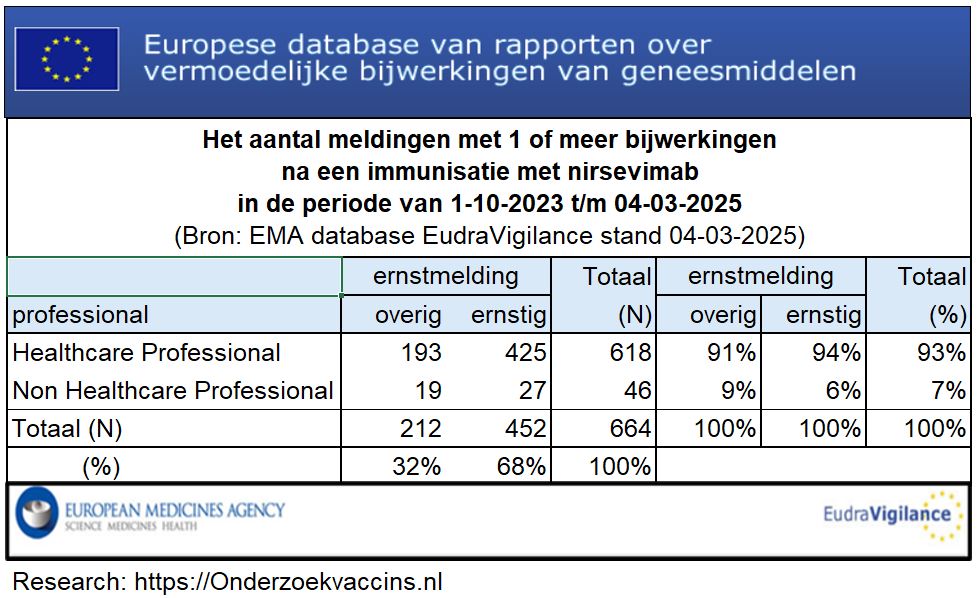 Afbeelding 6: Meldingen van bijwerkingen in EudraVigilance na een immunisatie met nirsevimab
Afbeelding 6: Meldingen van bijwerkingen in EudraVigilance na een immunisatie met nirsevimab
H4 Het criterium “Doelmatigheid van de immunisatie met nirsevimab”
Het beoordelingskader
Het onderdeel “Doelmatigheid van de vaccinatie” van het herziene beoordelingskader omvat het volgende criterium:
…”6. De verhouding tussen kosten en gezondheidswinst is gunstig in vergelijking met die van andere mogelijkheden om de ziektelast te reduceren.”…
[2] Herziening beoordelingskader voor vaccinaties (p.6/19)
Bij dit onderdeel wordt voornamelijk gekeken naar kosten van de immunisatie en de reductie van huisartsenbezoeken en ziekenhuisopnames ten gevolge van die immunisatie. De kosten van de (ernstige) bijwerkingen zijn door de Gezondheidsraad buiten beschouwing gelaten. Betrek je die er wel bij dan verdampt de gezondheidswinst snel.
Kanttekening bij berekening kosteneffectiviteit
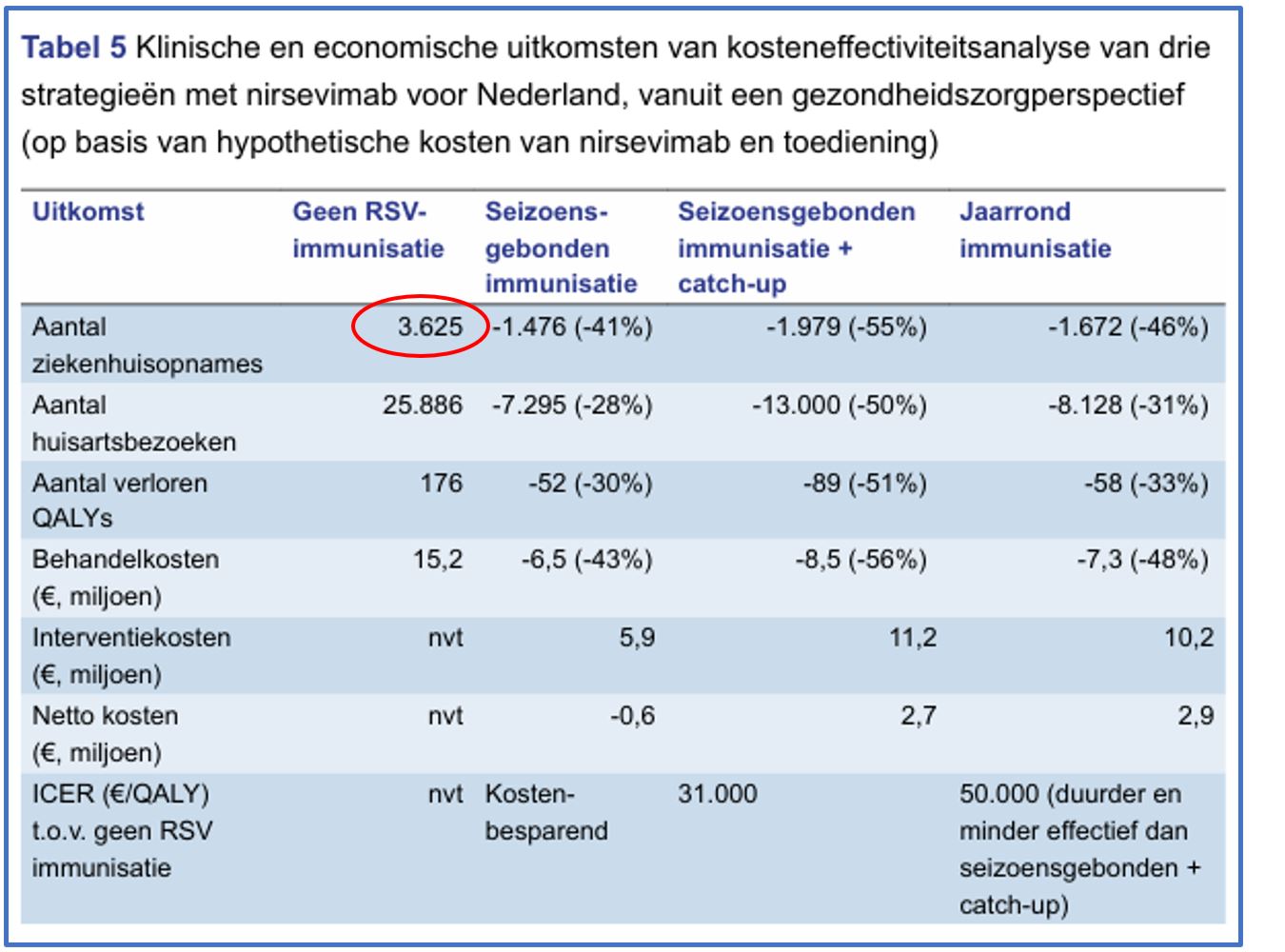 Afbeelding 7: Advies RSV Immunisatie tabel 5 p.32/51 [1]
Afbeelding 7: Advies RSV Immunisatie tabel 5 p.32/51 [1]
Bij het bepalen van de hypothetische kosten gaat de Gezondheidsraad in tabel 5 (zie Afbeelding 7) uit van 3.625 ziekenhuisopnames. Bij dit aantal leidt de reductie van 46% tot 1672 minder ziekenhuisopnames. In tabel 2 (zie Afbeelding 8) is sprake van gemiddeld 1676 ziekenhuisopnamen per jaar tussen 2013-2017. Met dat aantal zou de reductie op 771 (41% van 1676) zijn uitgekomen. Dat is een halvering.
Waarom de Gezondheidsraad het aantal van 3625 (tabel 5) in plaats van 1676 (tabel 2) gebruikt, wordt niet toegelicht in het advies.
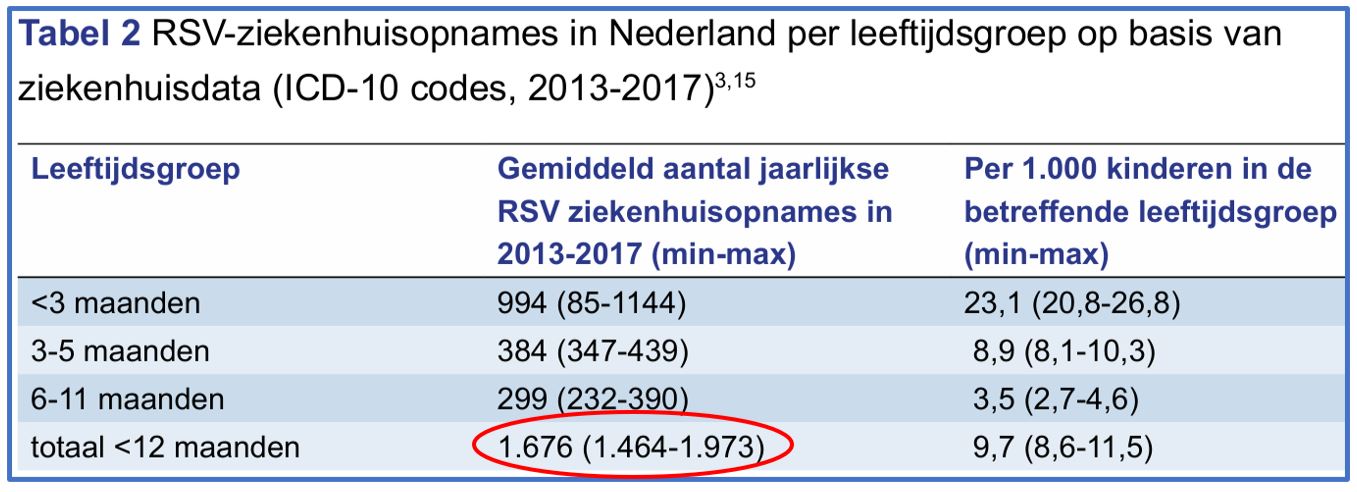 Afbeelding 8: Advies RSV Immunisatie tabel2 p.13/51 [1]
Afbeelding 8: Advies RSV Immunisatie tabel2 p.13/51 [1]
Gezondheidsraad negeert het risico van de nadelige gezondheidseffecten (bijwerkingen) op de gezondheidswinst.
In EudraVigilance en het fase 3 onderzoek staan meldingen van ernstige bijwerkingen en overlijden. Toch ontkent de Gezondheidsraad dat er ernstige bijwerkingen zijn bij het gebruik van nirsevimab. In het fase 3 onderzoek is sprake van 0,15% (3 op 1998) overlijdensgevallen in de nirsevimabgroep. Door het ontbreken van autopsierapporten is een relatie met de immunisatie niet uit te sluiten. Terwijl sterfte door RSV bij gezonde kinderen vrijwel niet voorkomt volgens de Gezondheidsraad.
…” In Nederland komt sterfte als gevolg van RSV bij kinderen zonder risico factoren vrijwel niet voor, en bij kinderen met risicofactoren weinig.”…
[1] Advies RSV Immunisatie (p.14/51)
Uit tabel 5 blijkt dat het aantal ziekenhuisopnamen dat kan worden voorkomen door immunisatie met nirsevimab tussen de 1500 en 2000 ligt. In het fase 3 onderzoek is ook nog sprake van 6,3% aan ernstige bijwerkingen in de nirsevimabgroep. Bedenk wel dat bij 1% (1600 van de 160.000) al een substantieel deel van de gezondheidswinst is verdwenen.
De Gezondheidsraad erkent dit zelfs niet als een latent risico.
H5 Samenvatting
De Gezondheidsraad heeft positief geadviseerd om kinderen in hun eerste levensjaar te immuniseren met nirsevimab. Bij drie criteria uit dat kader zijn inhoudelijke kanttekeningen geplaatst. Een overlappende tekortkoming bij deze criteria is het ontbreken van kwantitatieve grenswaarden. Daardoor is met vrijwel elke onderbouwing vast te stellen dat aan die criteria is voldaan.
A) Bij het vaststellen van de aanmerkelijke ziektelast bij 0,01% van de bevolking leunt Gezondheidsraad op de ruimte die zij zelf in het herziene beoordelingskader hebben gecreëerd.
B) De Gezondheidsraad heeft niet aannemelijk gemaakt dat de bijwerkingen van de immunisatie bij kinderen in hun eerste levensjaar geen belangrijke afbreuk doet aan de gezondheidswinst.
De kanttekeningen bij de volgende beweringen van de Gezondheidsraad onderbouwen dit.
Bewering 1: Er is geen verschil in ernstige bijwerkingen tussen nirsevimabgroep en placebogroep.
Kanttekeningen:
- Voor de ernstige bijwerkingen staat dit niet in de bron waar naar wordt verwezen.
- Ernstige bijwerkingen, die in de beide groepen voorkomen, kunnen een andere oorzaak hebben.
Bewering 2: Geen van de ernstige bijwerkingen houdt verband met nirsevimab.
Kanttekeningen:
- Deze bewering is niet terug te vinden in het onderzoek waar naar wordt verwezen en ook niet in de daarbij behorende appendix.
- Volgens de onderzoekers zijn de gemelde overlijdensgevallen in nirsevimabgroep niet te koppelen aan het vaccin. Autopsierapporten, die dat zouden moeten bevestigen, zijn niet beschikbaar.
- Een groep kinderen is uitgesloten bij het onderzoek. Dit geldt ook voor de omvang van het risico dat daarmee gepaard gaat. De Gezondheidsraad heeft dit punt in het advies niet aan de orde gesteld.
Bewering 3: …”In Spanje, waar tot nu toe 7.241 doses nirsevimab zijn toegediend, zijn geen ernstige bijwerkingen gerapporteerd.”…
Kanttekeningen:
- Door de bewering zonder context in het advies op te nemen laat de Gezondheidsraad essentiële informatie weg.
- Het gaat niet om een onderzoek met een controlegroep, maar om een immunisatiecampagne en deze is niet gericht op het achterhalen van bijwerkingen.
- De resultaten hebben alleen betrekking op deze immunisatiecampagne en zijn niet generaliseerbaar.
- Dat geen ernstige bijwerkingen in de 3 weken van immunisatiecampagne zijn gemeld wil niet zeggen dat die niet zijn opgetreden. Bij passieve monitoring van bijwerkingen treedt onderrapportage op.
- Deze bevinding van deze immunisatiecampagne wijkt af van het fase 3 onderzoek en EudraVigilance. Daaruit blijkt dat wel meldingen zijn geregistreerd van ernstige bijwerkingen binnen 3 weken na de immunisatie.
- Het negeren van de ernstige bijwerkingen doet afbreuk aan de hardheid van de verwachte gezondheidswinst in de bevolking.
C) De doelmatigheid is in het geding, omdat bij de berekening van de kosteneffectiviteit zonder een toelichting de meer gunstige cijfers voor ziekenhuisopnamen worden gebruikt en de kosten van ernstige bijwerkingen buiten beschouwing worden gelaten.
H6 Conclusie - Tot slot
Conclusie
De kanttekeningen laten zien dat af te dingen valt op de onderbouwing bij het positieve advies voor immunisatie tegen RSV in het eerste levensjaar .
Tot slot
Het is aan de lezer om te bepalen in hoeverre deze kanttekeningen afbreuk doen aan het oordeel van de Gezondheidsraad
De kanttekeningen hebben geen antivax motief, maar worden gemotiveerd vanuit een pro-safety houding.
Referenties
[1]
14-02-2025 Advies Gezondheidsraad: Immunisatie tegen RSV in het eerste levensjaar. Nr 2024/03
https://www.gezondheidsraad.nl/binaries/gezondheidsraad/documenten/adviezen/2024/02/14/advies-immunisatie-tegen-rsv-in-het-eerste-levensjaar/Immunisatie-tegen-RSV-in-het-eerste-levensjaar-advies.pdf
[2]
21-12-2023 Herziening beoordelingskader voor vaccinaties
https://www.gezondheidsraad.nl/documenten/overige/2023/12/21/herziening-beoordelingskader-voor-vaccinaties
[3]
LCI richtlijn RSV-infectie
https://lci.rivm.nl/richtlijnen/rsv-infectie
Geraadpleegd op 10-03-2025
[4a]
Muller WJ, Madhi SA, Seoane Nuñez B, Baca Cots M, Bosheva M, Dagan R, et al. Nirsevimab for Prevention of RSV in Term and LatePreterm Infants. N Engl J Med 2023; 388(16): 1533-1534.
Publicatiedatum: 05-04-2023
https://www.nejm.org/doi/full/10.1056/NEJMc2214773
[4b]
Nirsevimab for Prevention of RSV: Supplementary Appendix:
https://www.nejm.org/doi/suppl/10.1056/NEJMc2214773/suppl_file/nejmc2214773_appendix.pdf
[4c]
Termen die nauw verbonden zijn met het onderzoek van Muller et al. zijn:
- Clinical Trial NCT03979313
- Fase 2b/3 MELODY trial
- Harmonie
- D5290C00003 - D5290C00004
- MEDI8897 (voorloper nirsevimab)
[5]
Bron: Eurosurveillance 28(49) 2300606 (07/12/2023)
https://www.eurosurveillance.org/content/10.2807/1560-7917.ES.2023.28.49.2300606
[6]
https://journalsearches.com/journal.php?title=eurosurveillance
(geraadpleegd op 14-03-2025)
[7]
https://www.astrazeneca.com/media-centre/press-releases/2022/beyfortus-approved-in-the-eu-for-the-prevention-of-rsv-lower-respiratory-tract-disease-in-infants.html#
(geraadpleegd op 7-3-3025)
* * * * *
1 Naar: Homepage Onderzoekvaccins
2 Naar: Facebook Onderzoekvaccins
3 Naar: MeWe Onderzoekvaccins
4 Naar: Twitter: @onderzoekvaccin
5 Naar: Telegramkanaal Onderzoekvaccins
Abonneer je op het Telegramkanaal en je wordt op de hoogte gehouden van nieuwe publicaties op deze website. Het abonneren in Telegram is hetzelfde als volgen op Facebook.
* * * * *
Dagelijks krijgen we er te veel van binnen volgens het RIVM. Het lijdt tot aantasting van het immuunsysteem en is gerelateerd aan verschillende vormen van kanker. Geïnteresseerd in de problemen met betrekking tot PFAS? Bezoek mijn publicaties.
1 Naar: het PFAS overzicht op deze website
2 Naar: de Facebookpagina PFAS-Problematiek
3 Naar: telegramkanaal PFAS-Problematiek
